89
Полярная
( – )
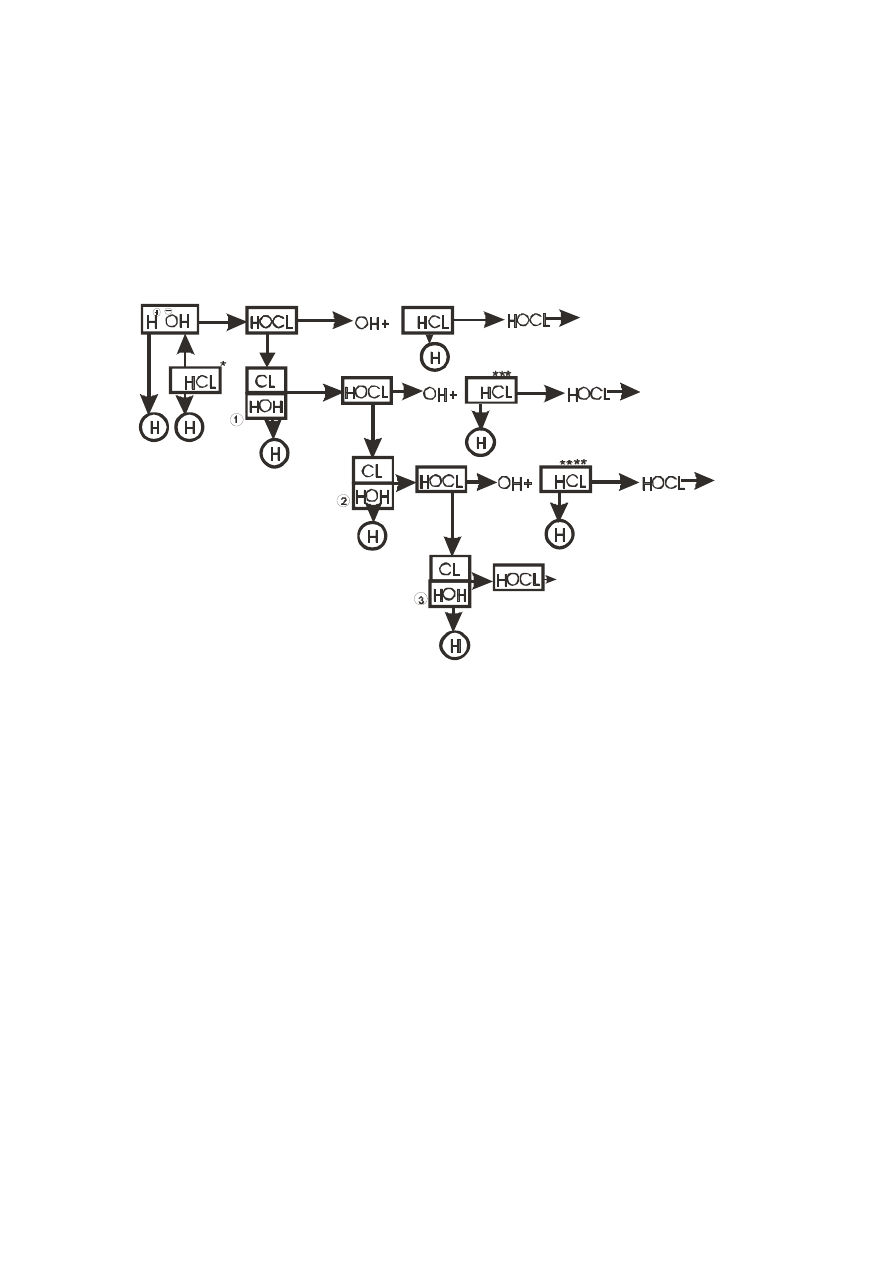
ОН группа исходной молекулы воды, играющая роль основания,
взаимодействует с молекулой HCl*. Образуется молекула хлорноватистой
кислоты HОCl.
Образовавшаяся молекула кислоты HOCl сразу же разрушается с выделением
хлора. Далее атомарный хлор взаимодействует с молекулой НОН(1); образуется
следующая молекула кислоты HOCl и после ее разложения появляется снова атом
Cl и ОН группа. Атом Cl взаимодействует со следующей молекулой НОН(2) и
вновь образуется кислотный атом Н и молекула HOCl; последняя, разлагаясь,
выделяет атом Cl и ОН группу. Атом Cl взаимодействует с новой молекулой
НОН(3) и процесс повторяется снова. Из приведенной схемы видно, что эта
реакция имеет цепной характер.
*
*
(11)
Далее группы ОН, выделяющиеся после разложения молекул HOCl,
взаимодействуют с последующими молекулами HCl, поступающими в воду. Так
молекула HСl**, взаимодействуя с ОН группой, образует новую молекулу HOCl и
атом Н. Последующие молекулы HCl*** и HCl**** взаимодействуют с ОН
группами по такой же схеме: образуются отдельные атомы Н и молекулы HOCl.
Цепной характер взаимодействия газа НCl с молекулами воды очевиден.
Из приведенной схемы видно, что кислотные атомы Н (то есть атом Н в
комплексе Н
2
О-Н) образуются из молекул воды, а инициатором диссоциации
молекулы НОН является отрицательно полярный атом Cl. Предполагаемый
механизм реакции взаимодействия молекул газа HCl с водой объясняет
практически 100 %-ную степень диссоциации HCl.
Электропроводность раствора зависит от степени диссоциации молекул
кислоты HCl, то есть от наличия электрически заряженных частиц. В нашем случае
носителем положительного электричества является гидрид молекулы воды;
представляющий собой электронейтральную, но полярную частицу Н
2
О-Н
( + )
,
носителем отрицательного электричества является электронейтральный, но
полярный атом Cl
( - )
, обладающий свободным валентным диполем, электрон
которого нарушает электрическую симметрию атома. Обращаем внимание читателя
на то, что в рассмотренной реакции никаких ионов не было. Кроме того, как видно
из схемы в процессе диссоциации молекул HCl половина кислотных атомов Н
образуется из молекул НОН, а вторая половина – из молекул HCl. Аналогичная
особенность характерна и для растворов других кислот.