63
Это увеличение объема на 9 % при замерзании воды за счет отделившихся
цепочек и выделившихся плотных кластерных структур позволяет считать, что в
жидкой воде при нормальных условиях присутствует примерно 9 % плотных
кластеров разной формы, составленных из молекул воды, соединенных своими
атомами кислорода.
Повышение температуры, например, от 4
0
С до 20
0
С приводит к
расшатыванию Н-связей, частичному их разрыву и увеличению расстояния между
молекулами, увеличению размера пор; происходит отделение цепочечных
структур, как от тетраэдрической, так и от плотной структуры. Можно сказать, что
происходит разделение фаз. Как видно из таблицы, плотность воды при 20
0
С
практически такая же, как у воды при 0
0
С. Это означает, что при понижении
температуры от 4
0
С тоже происходит процесс разделения фаз, как и при
повышении температуры от 4
0
С до 20
0
С, однако механизмы этих процессов
разные. При нагревании амплитуды колебаний молекул воды и связей между ними
увеличиваются. Это приводит к легкому освобождению цепочек из пористой
тетраэдрической сетки и разрыву Н-связей между тяжелыми плотными кластерами
и их отделению от общей тетраэдрической Н-связанной массы и началу ее
дифференциации на отдельные небольшие ассоциаты различной величины.
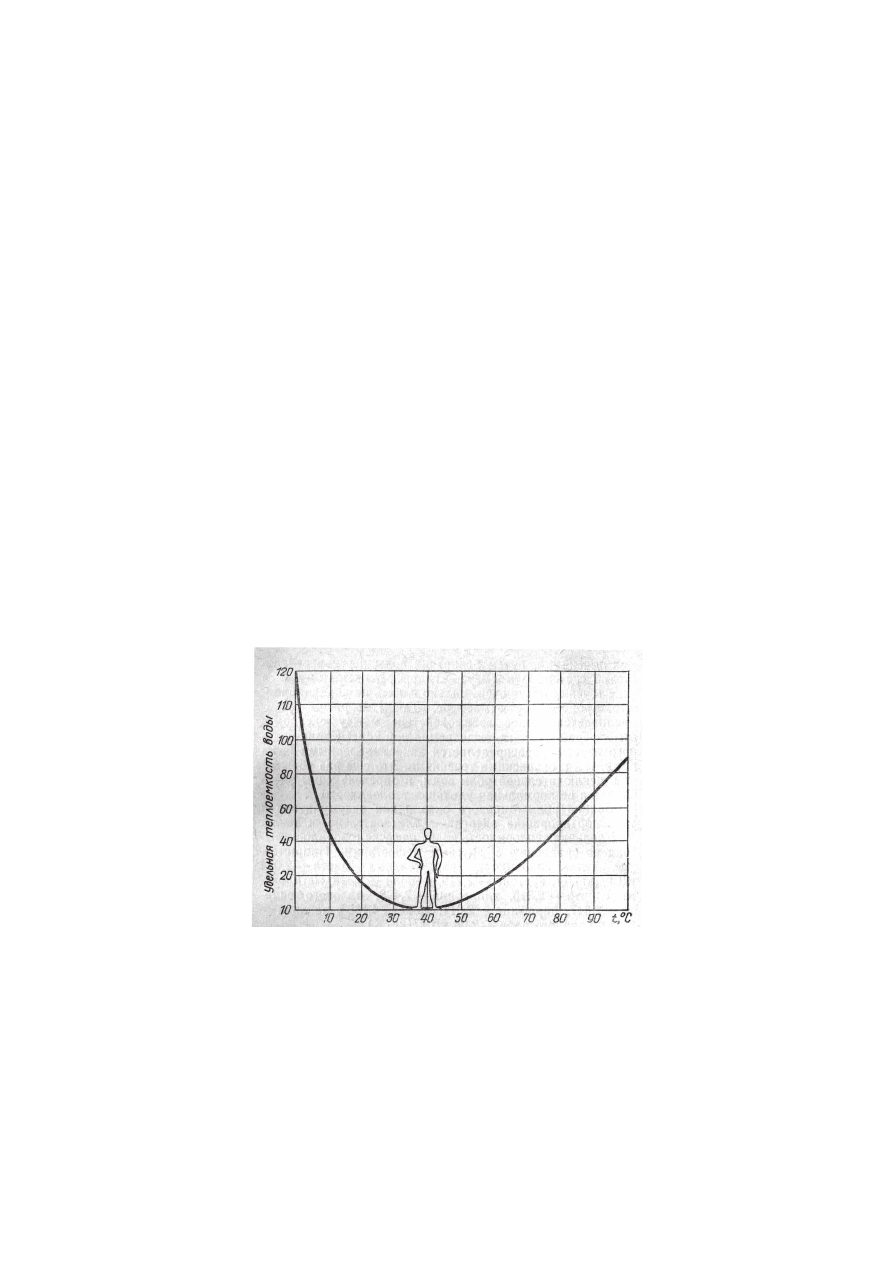
9.2 Аномальная теплоёмкость.
Рассмотрим еще одну особенность воды – ее аномальную теплоемкость.
Известно, что при нагревании вещества теплоемкость, как правило, возрастает.
Она различна при разных уровнях нагрева, но для любого вещества неизменно
повышается с увеличением температуры. Однако вода в этом отношении проявляет
аномальные свойства. В интервале температур от 0
0
С до 37
0
С теплоемкость
падает, т.е. вода имеет отрицательную теплоемкость, а от 37
0
С до 100
0
С – она
повышается (рис. 11).
Рис. 11. Температурная зависимость удельной теплоемкости воды.
(взято из В.В. Синюков. «Вода известная и неизвестная», Изд. «Знание» М., 1987, с.175)
Выше уже отмечалось, что вода состоит из двух структур или двух фаз. Одна
фаза (рыхлая) образована Н-связанными молекулами воды. Вторая фаза (плотная)
образована кластерами из молекул воды, связанных атомами кислорода. Энергия
химической квадруполь-квадрупольной связи между молекулами НОН гораздо
больше энергии Н-связи. При подводе тепла к объему воды плотная фаза,
состоящая из молекулярных кластеров достаточно малых или даже микроразмеров,
которых в общем объеме воды имеется небольшое количество (около 9 % по
объему), начинает претерпевать фазовое превращение; тепловая энергия в первую
очередь тратится на разрыв координационных (квадруполь-квадрупольных) связей