37
(5)
С
1
С
2
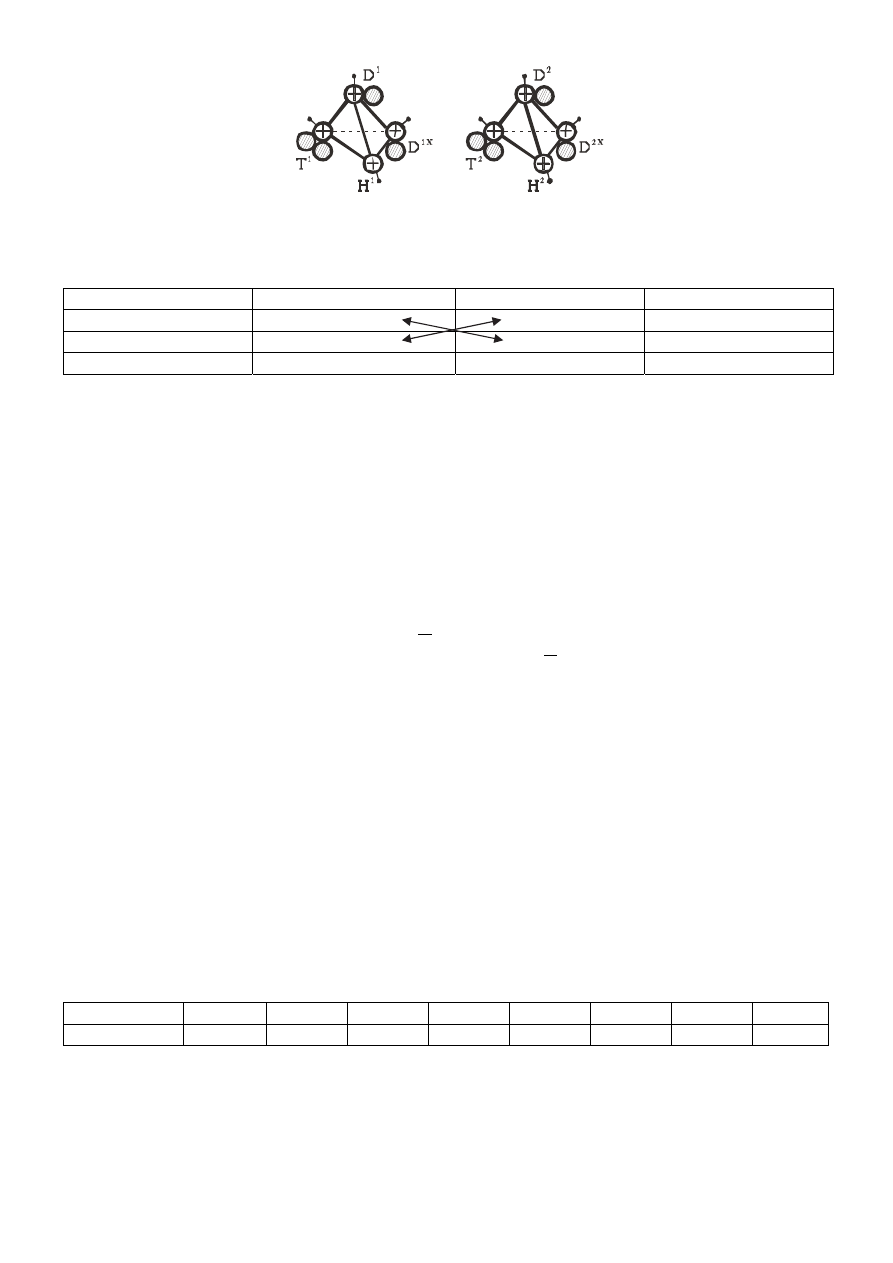
Количество возможных связей между двумя атомами углерода, равное 16-ти,
приведено в следующей таблице.
Т
1
-Т
2
D
1
-Т
2
D
1 X
-T
2
H
1
-T
2
Т
1
-D
2
D
1
-D
2
D
1 X
-D
2
H
1
-D
2
Т
1
-D
2 X
D
1
-D
2 X
D
1 X
-D
2 X
H
1
-D
2 X
Т
1
-H
2
D
1
-H
2
D
1 X
-H
2
H
1
-H
2
Из приведенного анализа видно, что простая связь С-С будет иметь
неоднозначные величины энергии связи. В различных справочниках и отдельных
публикациях эти величины составляют от 59 до 80 ккал/моль, что нельзя отнести к
случайным ошибкам экспериментов. Значительные расхождения имеются в
литературе и по оценке энергии связей С=С и С≡ С. Теперь становится понятной
причина различных энергий связей и почему двойные и тройные связи не являются
кратными величинами энергии одинарной С-С связи и почему в большинстве
случаев двойная связь разрывается в первую очередь. Из вышеприведённой
таблицы следует, что только в двух случаях из 16-ти возможно образование
равноценных двух связей С=С между двумя атомами углерода. Такая возможность
появляется тогда, когда два валентных диполя, обусловленные двумя атомами
дейтерия, одного тетраэдра атома С
1
взаимодействуют с двумя такими же
валентными дейтериями второго тетраэдра атома С
2
(в таблице эти два случая
взаимодействия обозначены двумя стрелками).
Энергии связей N-N→ от 32 до 60 ккал/моль, N=N →100 ккал/моль и N≡N→226
ккал/моль, также как и для атомов углерода, не являются кратными величинами
одинарной связи N-N по причине различия энергетики валентных диполей. То же
самое имеет место как в случае одинарной (от 33 до 50 ккал/моль), так и двойной
связи (от 96 до 118 ккал/моль) между двумя атомами кислорода.
Считаем, что разброс значений по оценке энергии связи между двумя атомами
заложен самой природой происхождения и формирования кристаллического атома;
любой атом асимметричен (кроме атомов инертных газов) как по распределению
массы (за счет присутствия разного количества нейтронов в изотопах водорода),
так и по смещению зарядов валентных диполей относительно электрического
центра тяжести кристалла атома [1, 5].
Атомы, именуемые как гетероатомы – О, N, S, имеющие величины ПИ ниже,
чем у атомов инертных газов, даже в нормальных условиях имеют гораздо более
низкую интенсивность колебательного движения в диполях и квадруполях по
сравнению с атомами инертных газов.
атом
Не Ne Ar Kr Xe N O S
ПИ (эв)
24,5 21,5 15,7 13,9 12,1 14,53 13,62
10,36
Это приводит к тому, что даже в нормальных условиях квадруполь-
квадрупольное взаимодействие для атомов N, O и S становится более значимым и
обладает большей энергией. Например, квадруполь-квадрупольное взаимодействие
между атомами кислорода позволяет расширить количество возможных способов
взаимодействия этих атомов.