34
квадруполь-квадрупольной связи. Квадруполи двух атомов располагаются
перпендикулярно по отношению друг к другу; образуется симметричная
устойчивая структура в виде тетраэдра из четырех протонов, между которыми
размещены четыре электрона. Сила квадруполь-квадрупольного взаимодействия
будет слабее линейной диполь-дипольной связи, а также слабее треугольной
диполь-квадрупольной связи, состоящей из трех протонов, разделенных тремя
электронами.
Потенциалы ионизации (ПИ) атомов инертных газов имеют наибольшие
величины по сравнению с остальными атомами химических элементов. Это указывает
на то, что эти атомы обладают большой энергией, и диполи (p
+
- ē) в составе
квадруполей имеют большую энергию колебательных движений и высокую частоту
колебаний. Для того чтобы атомы инертного газа при соприкосновении могли как-то
взаимодействовать друг с другом, надо понизить их энергию. Для того чтобы
понизить энергию колебательной составляющей атома инертного газа, необходимо
понизить его температуру. Инертный газ переходит в состояние жидкости только
после сильного охлаждения и только теперь могут быть осуществлены квадруполь-
квадрупольные взаимодействия между атомами, что в конечном результате приводит
к образованию жидкости.
Кроме взаимодействия между собой атомов инертных газов, известны и другие
примеры взаимодействия между валентно насыщенными молекулами. Так в [6]
отмечается, что валентно насыщенные молекулы NH
3
и BF
3
образуют соединение
NH
3*
BF
3
с выделением значительной энергии. С позиций теории кристаллического
строения атома [1] образование прочной химической связи между выше названными
молекулами объясняется следующим образом. В молекуле NH
3
кристалл атома азота
имеет тетраэдрическое строение. В трех вершинах тетраэдра располагаются три
валентных диполя (p
+
- ē), которые образуют диполь-дипольные связи с тремя
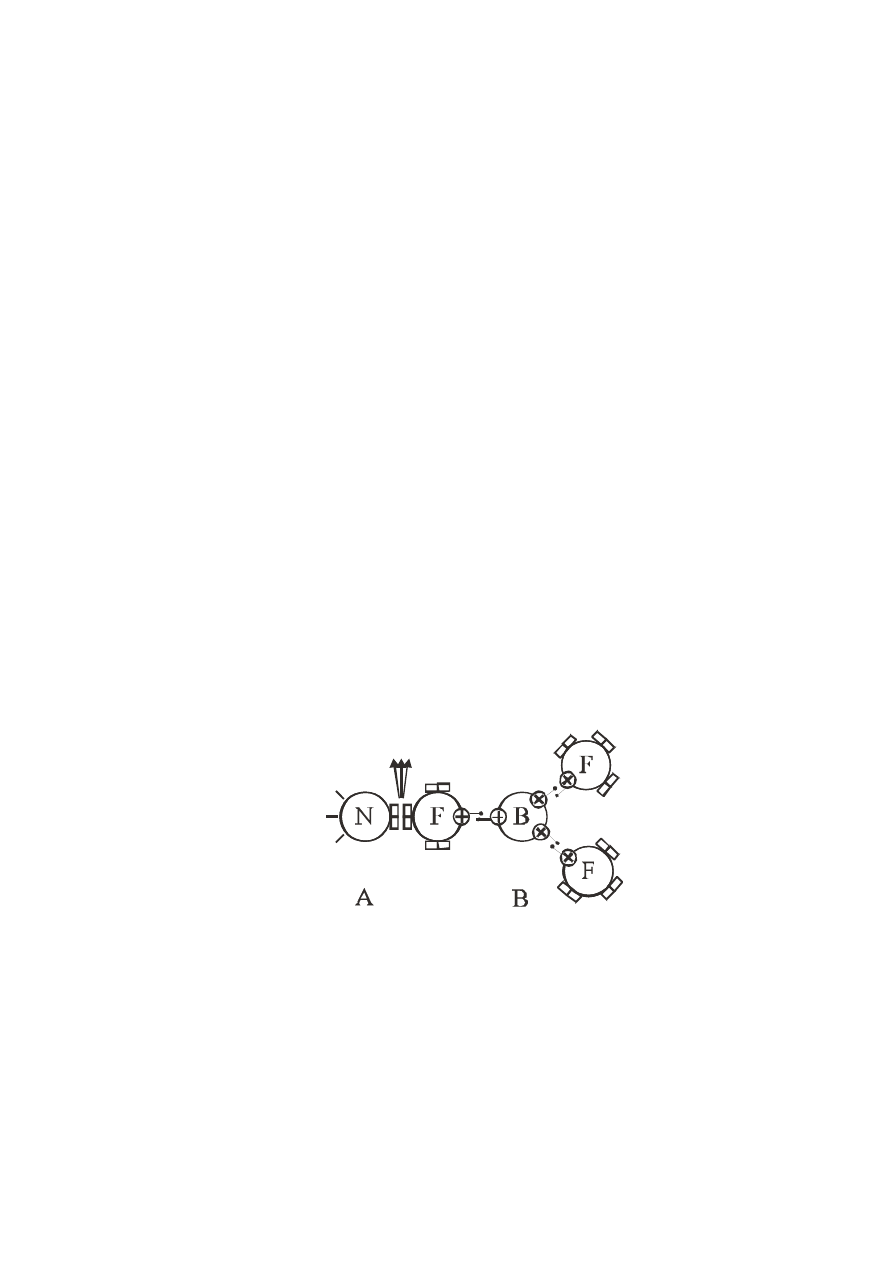
атомами водорода, а в четвертой вершине расположен квадруполь (на схеме молекула
А). В молекуле BF
3
кристалл атома бора имеет три валентных диполя, квадруполей
нет. Атом фтора имеет один валентный диполь и три квадруполя (табл. 1) (на схеме
молекула В).
H
H
H
E
H N BF
3
3
.
Связь между этими молекулами и образование устойчивого соединения может
произойти только через взаимодействие их квадруполей, которые располагаются
перпендикулярно друг к другу с образованием тетраэдра из четырех протонов,
между которыми располагаются четыре электрона. Если при этом выделяется
значительное количество энергии, значит, квадруполи имеют существенную
энергию.
В качестве ещё одного примера образования квадруполь-квадрупольной связи
между молекулами рассмотрим строение диборана. Как отмечается в [6], боран
ВН
3
, в котором все три валентности бора насыщены, димеризуется с выделением
значительной энергии. Образуются прочная молекула диборана.
Согласно нашим представлениям о кристаллическом строении атома, в
соответствии с табл. 1 и 4, атом бора имеет один валентный диполь,